19.07.2023
Аннотация
Внутрипузырная химиотерапия может вызвать химический цистит и связанные с ним симптомы нижних мочевых путей (СНМП). Целью этого исследования было оценить эффективность и безопасность перорального приёма препарата гиалуроновой кислоты (ГК), хондроитинсульфата, куркумина и кверцетина (мягкие гели Ialuril®) для снижения тяжести СНМП у пациентов с раком мочевого пузыря в анамнезе при внутрипузырной химиотерапии. Мы разработали моноцентровое рандомизированное двойное слепое плацебо-контролируемое пилотное исследование. В исследование были включены пациенты, направленные в наш институт в период с ноября 2016 г. по март 2018 г. Все субъекты страдали от мышечно-неинвазивного рака мочевого пузыря и получали внутрипузырную химиотерапию митомицином-С. Пациенты были рандомизированы в соотношении 1:1 на две группы (группа вмешательства и контрольная). Всем испытуемым перорально вводили препараты (мягкие гели Ialuril® или плацебо), начиная за неделю до первой еженедельной инстилляции и заканчивая через 30 дней после последней, затем начиная за неделю до каждой ежемесячной инстилляции и заканчивая через 14 дней после нее. Для оценки эффективности лечения использовали Международную шкалу оценки симптомов заболеваний предстательной железы (IPSS) и визуальную аналоговую шкалу (ВАШ) от 0 до 100. Также были описаны нежелательные явления. Пациенты оценивались на исходном уровне и после 1, 4, 7 и 13 месяцев внутрипузырной химиотерапии. Всего было зарегистрировано 34 пациента. Среднее значение баллов по Международной шкале оценки симптомов заболеваний предстательной железы было значительно ниже в группе вмешательства по сравнению с контрольной группой: 4 балла (13 баллов против 17 баллов; р = 0,038), 7 баллов (10 баллов против 18 баллов; р < 0,001) и 13 баллов (10 баллов против 17 баллов; p = 0,002). Среднее значение по ВАШ была значительно ниже в группе вмешательства по сравнению с контрольной группой через 7 (22 балла против 37 баллов; p = 0,021) и 13 (20 баллов против 35 баллов; p = 0,024) месяцев. Не было зарегистрировано ни одного нежелательного явления, связанного конкретно с добавкой или плацебо. Пероральная форма ГК, хондроитинсульфата, кверцетина и куркумина может быть эффективным и безопасным средством поддерживающей терапии против химического цистита у пациентов, получающих внутрипузырную химиотерапию при раке мочевого пузыря.
1. Введение
Рак мочевого пузыря занимает 7-е место среди наиболее часто диагностируемых опухолей у мужчин во всем мире и 10-е место, если учитывать оба пола. Стандартизированный по возрасту показатель заболеваемости в мире (на 100 000 человек/год) составляет 9,5 и 2,4 у мужчин и женщин соответственно [1]. Курение является наиболее важным фактором риска возникновения рака мочевого пузыря, на его долю приходится примерно 50% случаев [2,3]. Уротелиальная карцинома соответствует примерно 90% всех опухолей мочевого пузыря [4]. Диагноз рак мочевого пузыря ставится на основании цистоскопии и гистологической оценки образца ткани с помощью холодной биопсии или, чаще всего, резекции, включающей трансуретральную резекцию мочевого пузыря. Целью трансуретральной резекции является постановка правильного гистологического диагноза, локальное стадирование и полное удаление всех видимых поражений [5]. Трансуретральная резекция мочевого пузыря может полностью удалить опухоль Та/Т1, хотя эти поражения обычно рецидивируют и прогрессируют до мышечно-инвазивного рака, что делает адъювантную внутрипузырную терапию ключевым вмешательством в этой ситуации [6,7].
Тип адъювантной терапии после трансуретральной резекции должен основываться на риске рецидива. У пациентов с низким риском рецидива и у отдельных пациентов с промежуточным риском рекомендуется одна немедленная инстилляция химиотерапии. Пациентам с опухолями промежуточного риска рекомендуется однолетнее внутрипузырное введение полной дозы бациллы Кальмета-Герена (БЦЖ) или инстилляции химиотерапии в течение максимум одного года. Пациентам с высоким риском показано внутрипузырное введение полной дозы БЦЖ в течение одного-трех лет [5].
Внутрипузырная химиотерапия может вызывать системные побочные эффекты из-за всасывания через эпителий мочевого пузыря; однако местная токсичность встречается чаще [8]. Введение цитотоксической химиотерапии в мочевой пузырь может вызвать дизурию, учащенное мочеиспускание, императивные позывы, надлобковый дискомфорт, макрогематурию и тазовую боль [9]. Эти симптомы в совокупности относятся к химическому циститу, частота возникновения которого составляет около 10% [10,11]. Некоторые пациенты могут не завершить запланированное лечение из-за тяжелых симптомов нижних мочевых путей (СНМП) с возможным ухудшением онкологических исходов [10]. Более того, СНМП, по-видимому, являются важным фактором, связанным с ухудшением качества жизни этих пациентов [12].
Уротелий мочевого пузыря обеспечивает защитный барьер от проникновения токсических агентов, мочи и бактерий. Слой гликозаминогликанов состоит из толстого слизистого слоя гликопротеинов и протеогликанов на поверхности уротелиальных клеток [13]. Основными компонентами этого поверхностного слоя являются хондроитинсульфат и гиалуроновая кислота (ГК). Повреждение слоя гликозаминогликанов в результате ряда патологических процессов изменяет его защитно-барьерную функцию, что приводит к увеличению проницаемости в глубокие слои уротелия и, в конечном счете, может вызывать императивные позывы, учащение мочеиспускания и боль [14].
Было предложено внутрипузырное и пероральное введение ГК и хондроитинсульфата для восстановления слоя гликозаминогликанов и, следовательно, для улучшения симптомов у пациентов с болевым синдромом мочевого пузыря, рецидивирующим бактериальным циститом, лучевым и химическим циститом [15,16]. Хотя некоторые добавки были положительно оценены в контексте воспалительных заболеваний мочеполового тракта [17], в настоящее время нет исследований, изучающих влияние перорального введения этих молекул на пациентов, проходящих внутрипузырную химиотерапию.
Основная цель исследования состояла в том, чтобы оценить эффективность перорального препарата ГК, хондроитинсульфата, кверцетина и куркумина после внутрипузырной химиотерапии мышечно-неинвазивного рака для снижения тяжести сопутствующих СНМП. Вторичной целью была оценка нежелательных явлений, связанных с пероральным приёмом препарата в тех же условиях.
2. Материалы и методы
2.1. Дизайн исследования
Мы разработали моноцентровое рандомизированное двойное слепое плацебо-контролируемое пилотное исследование. Оно было одобрено Этическим комитетом Университета Кампании «Луиджи Ванвителли» (№ 519–03/05/16) и проведено в соответствии с Хельсинкской декларацией об этических принципах проведения медицинских исследований с участием людей.
Пациенты, направленные в наш центр в период с ноября 2016 г. по март 2018 г., были включены в исследование после предоставления письменного информированного согласия, включая согласие на публикацию данных. Во время регистрации пациенты были рандомизированы в две группы (группа вмешательства и контрольная) с соотношением распределения 1:1 при помощи составленного компьютером случайного списка.
2.2. Критерии включения и исключения
Все пациенты были старше 18 лет, имели в анамнезе ранее перенесенную трансуретральную резекцию с диагнозом мышечно-неинвазивный рак мочевого пузыря, и им была назначена внутрипузырная химиотерапия в соответствии с действующими рекомендациями [5].
Были исключены пациенты со следующими характеристиками: мышечно-инвазивный рак мочевого пузыря; карцинома; внутрипузырная иммунотерапия бациллой Кальмета-Герена (БЦЖ); сопутствующие инфекции мочевыводящих путей; аномалии или дисфункции мочевыводящих путей; использование других добавок, которые содержат аналогичные активные вещества или которые могут помешать оценке исследования; любые абсолютные противопоказания к лекарствам или добавкам, используемым в исследовании.
2.3. Оценка пациентов и сбор данных
Пациенты оценивались на исходном уровне и через 1, 4, 7 и 12 месяцев внутрипузырной химиотерапии.
На исходном уровне были собраны следующие данные: демографическая информация, история болезни, физикальное обследование, анализ мочи, посев мочи и ультразвуковое исследование мочевыводящих путей. Был зарегистрирован тип (первичный или рецидивирующий), очаговость, гистология, степень и патологическая стадия рака мочевого пузыря. Объем остаточной мочи после мочеиспускания, максимальная скорость потока (Qmax), оценка по Международной шкале оценки симптомов заболеваний предстательной железы и визуальной аналоговой шкале (ВАШ) от 0 до 100 для описания беспокойства от СНМП были произведены пациентами самостоятельно во время исходного визита. Анализ мочи, посев мочи, оценки по Международной шкале оценки симптомов заболеваний предстательной железы и визуальной аналоговой шкале повторялись во время последующих посещений. Стандарт Международной шкалы оценки симптомов заболеваний предстательной железы использовался как для мужчин, так и для женщин. Баллы ВАШ колебались от 0 (нет беспокойства) до 100 (сильнейшее беспокойство, какое только можно себе представить). Регистрировались все нежелательные явления в течение периода исследования.
2.4. Протокол лечения
В ходе исследования использовались пероральный препарат (капсула) ГК 20 мг, хондроитинсульфата 200 мг, кверцетина 200 мг, куркумина 200 мг (мягкие гели Ialuril®, IBSA Farmaceutici, Lodi, Италия) и внутрипузырный препарат митомицина-С 40 мг.
Внутрипузырная химиотерапия проводилась по протоколу 1 инстилляция в неделю в течение первого месяца и 1 инстилляция в месяц в течение последующих 12 месяцев. Также всегда выполнялась однократная инстилляция сразу после операции [5].
Пероральный препарат (добавка или плацебо) принимали по следующей схеме: 2 капсулы в одно и то же время утром, начиная за неделю до первой еженедельной инстилляции и заканчивая через 30 дней после последней, а затем по 2 капсулы в одно и то же время утром, начиная за неделю до каждой месячной инстилляции и заканчивая через 14 дней после нее.
2.5. Статистика
Среднее значение использовали как меру центральной тенденции, а межквартильный интервал (IQR) – как меру статистической дисперсии. В качестве критерия нормальности использовали критерий Шапиро-Уилка. Критерии Уилкоксона (парные или непарные) и критерий хи-квадрат использовались для оценки различий между двумя группами и в одной и той же группе при различных визитах для последующего наблюдения. Статистическая значимость была произвольно установлена для значения p <0,05. Статистический пакет IBM для социальных наук (IBM Corp., выпущенный в 2015 г. IBM SPSS Statistics for Windows, Version 23.0. Armonk, Нью-Йорк, США, IBM Corp.) использовался для статистического анализа.
3. Результаты
Всего для анализа было доступно 34 пациента: 19 в группе плацебо и 15 в группе приёма добавок (рис. 1). Исходные характеристики были одинаковыми между двумя группами (таблица 1). Все опухоли мочевого пузыря были мышечно-неинвазивными уротелиальными карциномами. Достоверной разницы (p > 0,05) в типе, очаговости, степени и патологической стадии рака мочевого пузыря между двумя группами обнаружено не было (табл. 2). Все пациенты в обеих группах завершили запланированные визиты.
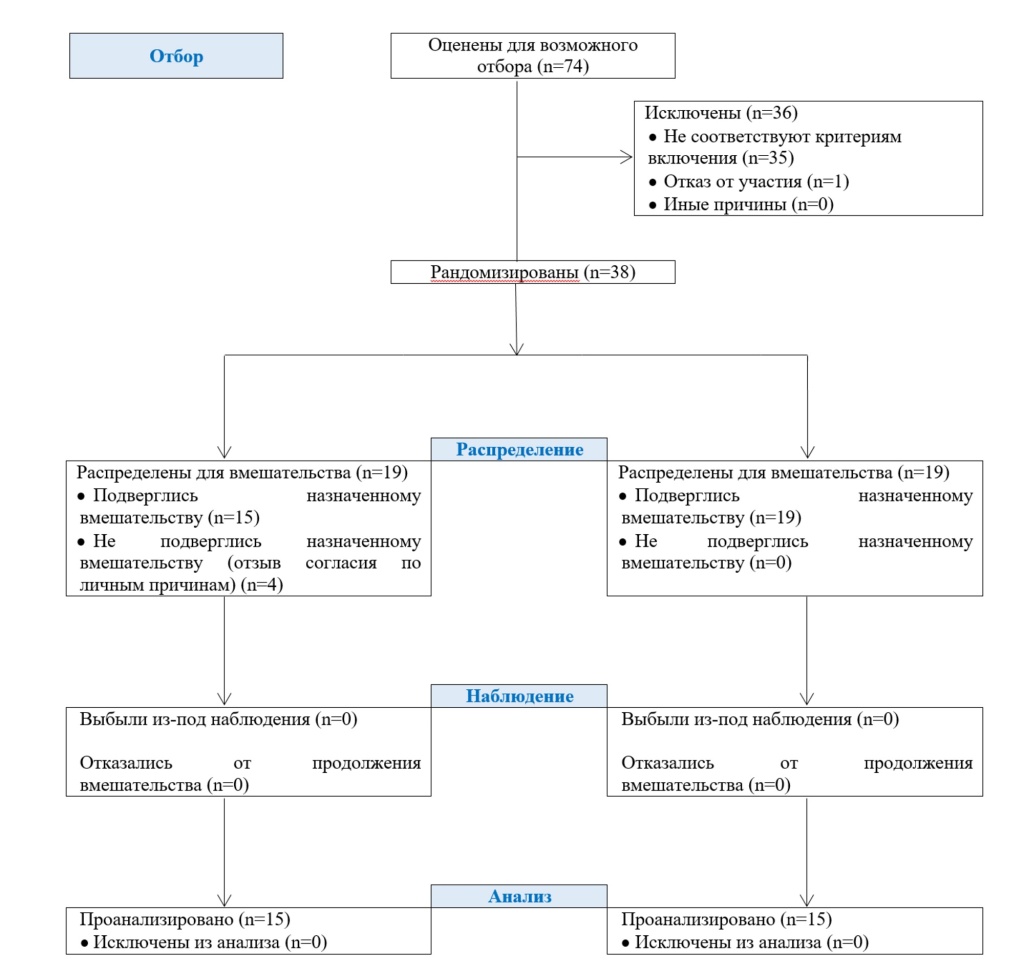
Рисунок 1
Таблица 1
Исходные характеристики пациентов.
|
|
Группа вмешательства (n = 15) |
Контрольная группа (n = 19) |
p-величина
|
|
Возраст |
|
|
0.082 |
|
Средняя величина (МКИ) |
73 |
69 |
|
|
Пол N (%) |
|
|
0.118 |
|
Мужчины Женщины |
13 (86.7) |
15 (79.0) |
|
|
ВАШ |
|
|
0.103 |
|
Средняя величина (МКИ) |
21.0 |
28.0 |
|
|
Международная шкала оценки симптомов заболеваний предстательной железы |
|
|
0.061 |
|
Средняя величина (МКИ) |
14.0 |
14.0 |
|
|
Международная шкала оценки симптомов заболеваний предстательной железы (качество жизни) |
|
|
0.088 |
|
Средняя величина (МКИ) |
3 |
3 |
|
|
Максимальная скорость потока |
|
|
0.213 |
|
Средняя величина (МКИ) |
13.5 |
14.1 |
|
|
Объём остаточной мочи после мочеиспускания |
|
|
0.191 |
|
Средняя величина (МКИ) |
10.0 |
7.0 |
ВАШ – визуальная аналоговая шкала; МКИ – межквартильный интервал.
Таблица 2
Характеристика опухолей мочевого пузыря.
|
|
Группа вмешательства (n = 15) |
Контрольная группа (n = 19) |
p-величина
|
|
Тип N (%) |
|
|
0.012 |
|
Первичный Повторный |
13 (86.7) |
16 (84.2) |
|
|
Очаговость N (%) |
|
|
0.233 |
|
Монофокальный Мультифокальный |
8 (53.3) |
10 (53.6) |
|
|
Гистотип N (%) |
|
|
0.087 |
|
Уротелиальный Не уротелиальный |
15 (100) |
19 (100) |
|
|
Градация N (%) |
|
|
0.122 |
|
Слабо выраженный Сильно выраженный |
11 (73.3) |
15 (79.0) |
|
|
Патологическая стадия N (%) |
|
|
0.093 |
|
Ta T1 |
9 (60.0) |
12 (63.2) |
|
|
Группа риска EAU N (%) |
|
|
0.321 |
|
Низкий риск Промежуточный риск |
12 (80) |
14 (73.7) |
EAU – Европейская ассоциация урологов
Среднее значение для баллов по Международной шкале оценки симптомов заболеваний предстательной железы было значительно ниже в группе вмешательства по сравнению с контрольной группой: 4 (13 баллов против 17 баллов; р = 0,038), 7 баллов (10 баллов против 18 баллов; р < 0,001) и 13 баллов (10 баллов против 17 баллов; p = 0,002). По сравнению с исходным уровнем значительное улучшение (p < 0,05) по Международной шкале оценки симптомов заболеваний предстательной железы было зарегистрировано в группе вмешательства через 7 и 13 месяцев, в то время как значительное ухудшение (p < 0,05) по Международной шкале оценки симптомов заболеваний предстательной железы было зафиксировано в контрольной группе при каждом последующем визите (таблица 3). Среднее значение по ВАШ было значительно ниже в группе вмешательства по сравнению с контрольной группой через 7 месяцев (22 балла против 37 баллов; p = 0,021) и 13 месяцев (20 баллов против 35 баллов; p = 0,024). По сравнению с исходным уровнем не было зарегистрировано значимой разницы (p > 0,05) в баллах по ВАШ в группе вмешательства при каждом последующем визите, в то время как в контрольной группе наблюдалось значительное ухудшение (p < 0,05) в баллах по ВАШ при каждом последующем контрольном визите (таблица 4). Тенденция по Международной шкале оценки симптомов заболеваний предстательной железы и ВАШ во время наблюдения в обеих группах показана на рисунке 2. Было подтверждено, что показатели по Международной шкале оценки симптомов заболеваний предстательной железы и ВАШ во время последнего наблюдения значительно улучшились (p < 0,05) в группе вмешательства по сравнению с контрольной группой при отдельном анализе мужчин и женщин. Достоверных различий (р > 0,05) по Международной шкале оценки симптомов заболеваний предстательной железы и ВАШ между группами в зависимости от возраста выявлено не было. Среднее значение по Международной шкале оценки симптомов заболеваний предстательной железы (качество жизни) (IPSS-QoL) на исходном уровне существенно не отличалось между двумя группами (p = 0,088). Во время последнего наблюдения баллы по IPSS-QoL были значительно лучше в группе вмешательства (5,0 против 3,0; p = 0,021). Не было зарегистрировано ни одного нежелательного явления, связанного конкретно с приёмом добавки или плацебо. Дизурия встречалась значительно реже (p = 0,029) в группе вмешательства. Местные побочные эффекты внутрипузырной химиотерапии представлены в таблице 5. Системные нежелательные явления, связанные с внутрипузырной химиотерапией, не описаны.
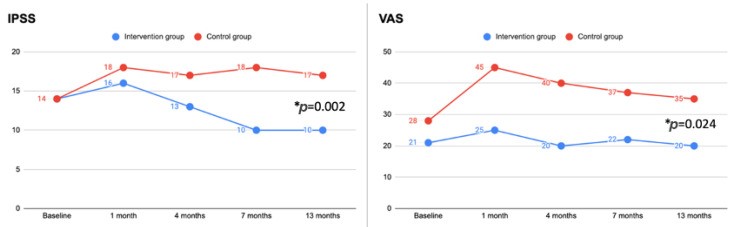
Рис. 2
Международная шкала оценки симптомов заболеваний предстательной железы и Визуальная аналоговая шкала в период исследования. Все пациенты в обеих группах завершили запланированные визиты (группа вмешательства n = 15, контрольная группа n = 19). Значения представлены как средние.
IPSS: международная шкала оценки симптомов заболеваний предстательной железы.
VAS: визуальная аналоговая шкала (0–100).
* Относится к последнему контрольному визиту (13 месяцев).
Продолжение статьи
 Версия для слабовидящих
Версия для слабовидящих


