07.08.2018
Предыдущая статья
Известно, что в последнее время злокачественные новообразования органов малого таза стали встречаться значительно чаще, причем возраст онкологических больных снизился. Пациенты, страдающие злокачественными новообразованиями шейки матки, мочевого пузыря, прямой кишки, предстательной железы, нередко подвергаются лучевой и / или химиотерапии.
Хорошо известным осложнением лучевой терапии является лучевой геморрагический цистит, представляющий собой реакцию эпителия мочевого пузыря и уретры на облучение [1].
При лучевом цистите микроскопически определяется первичный дефект защитного гликозаминогликанового (ГАГ) слоя уротелия [2]. В норме ГАГ-слой представляет собой защитный барьер, предохраняющий уротелий от повреждения вследствие воздействия микроорганизмов, токсичных компонентов мочи и нервные окончания в lamina propria – от деполяризации из‑за контакта с ионами калия.
Таким образом, разрушение ГАГ-слоя вследствие радиации приводит к воздействию на уротелий агрессивных компонентов мочи, а также ионов калия, что в свою очередь ведет к возникновению симптомов, характерных для лучевого цистита, подобно интерстициальному [3].
Разрушение ГАГ-слоя уротелия при лучевом цистите подтверждается патоморфологически. Кроме того, определяется прогрессирующая облитерация кровеносных сосудов, приводящая к ишемии уротелия.
Следствие данного процесса – возникновение язвенных дефектов слизистой оболочки мочевого пузыря. В качестве ответа на гипоксию в пораженных участках индуцируется неоангиогенез, однако новые артериолы и капилляры более хрупкие, и при наполнении мочевого пузыря возникают геморрагические явления, которые проявляются подслизистыми кровоизлияниями и микро- или макрогематурией [4] (рис. 1).
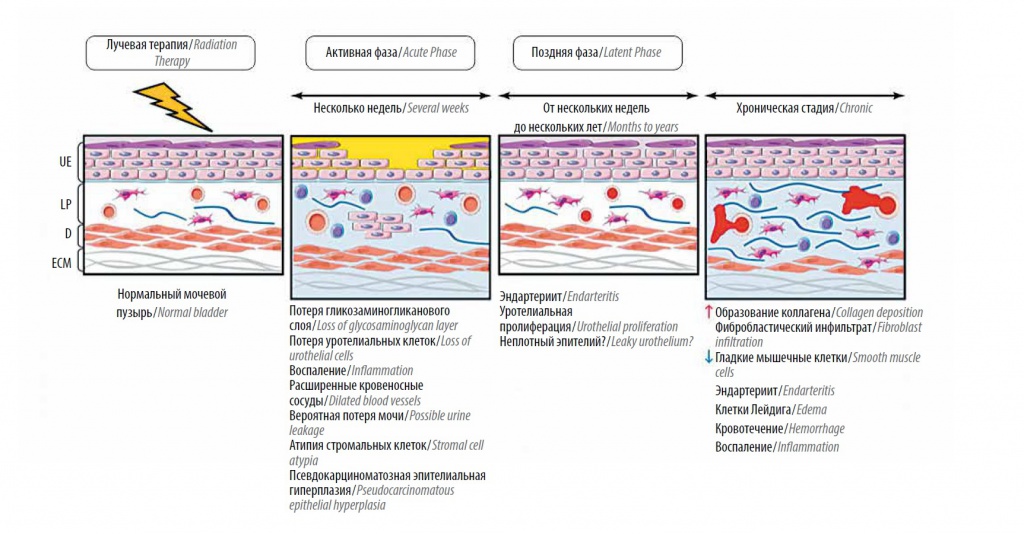
Рис. 1. Патогенез лучевого цистита
0. Отсутствие изменений.
1. Слабо выраженная атрофия эпителия, незначительные телеангиэктазии, микрогематурия.
2. Выраженная поллакиурия, генерализованные телеангиэктазии, интермиттирующая макрогематурия.
3. Резко выраженная поллакиурия и дизурия, значительные генерализованные телеангиэктазии, часто с петехиальными кровоизлияниями, частая
макрогематурия, снижение емкости мочевого пузыря <150 мл.
4. Некроз стенки мочевого пузыря, микроцист (<100 мл), тяжелый геморрагический цистит.
5. Смерть.
M. J. Droller и соавт. выделяют 4 степени геморрагического цистита [5]:
• микрогематурия;
• макрогематурия;
• макрогематурия с незначительными сгустками крови;массивная макрогематурия со значительными сгустками крови, вплоть до гемотампонады мочевого пузыря.
Согласно классификации Европейской организации по исследованию и лечению рака (EORTC), лучевой цистит имеет 3 стадии:
• острую (3–12 мес);
• латентную (бессимптомную, до 10 лет);
• хроническую (отдаленные лучевые повреждения).
Отдаленные лучевые повреждения являются наиболее тяжелыми. Онкологическая группа по лучевой терапии (RTOG) выделяет 6 степеней тяжести хронического лучевого цистита [6].
Лечение отдаленных лучевых поражений слизистой оболочки мочевого пузыря остается сложной задачей. В ретроспективе для терапии хронического лучевого цистита назначали Меснекс (2‑меркаптоэтансульфонат натрия), непрерывную ирригацию мочевого пузыря, внутривенную гипергидратацию в сочетании с форсированным диурезом. Однако результаты были противоречивы [7, 8]. Весьма перспективные результаты показало использование гипербарической оксигенации [9].
Также применялись различные виды внутрипузырных инстилляций:
• аминокапроновой кислоты (непрерывная ирригация в дозе 1 г / ч в течение 8–24 ч). Основной недостаток этого метода – образование крупных сгустков, эвакуация которых из мочевого пузыря затруднена [10];
• сульфата алюминия (непрерывная ирригация 1 % раствора со скоростью 250 мл / ч). Для купирования макрогематурии требовалось 3–4 сут [11]. К сожалению, от метода отказались из‑за серьезных побочных эффектов [12];
• 0,5–1,0 % раствора нитрата серебра с экспозицией 10–20 мин для химической коагуляции кровоточащих участков слизистой оболочки.
Этот метод является потенциально опасным для верхних мочевых путей вследствие возможного рефлюкса [13]; 1–2 % формалина (под давлением 15 см водного столба в течение 15 мин). Метод продемонстрировал определенную эффективность, но не получил широкого распространения [14].
Из альтернативных методов лечения известна суперселективная эмболизация артерий мочевого пузыря. Метод сложен технически, его частым осложнением является боль в ягодицах вследствие окклюзии верхней ягодичной артерии [15].
В последние годы широкое распространение получила так называемая гликозаминогликанзаместительная терапия, направленная на восстановление защитного слоя уротелия.
Поскольку ГАГ-слой мочевого пузыря состоит из гиалуроновой кислоты, хондроитинсульфата, гепарансульфата и дерматансульфата (рис. 2), гликозаминогликанзаместительная терапия предусматривает введение в мочевой пузырь одного из этих веществ или их комбинации.
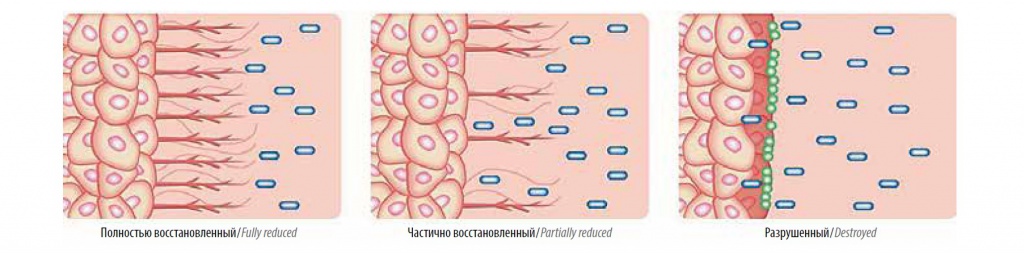
Рис. 2. Строение гликозаминогликанового слоя уротелия
Инстилляции в мочевой пузырь хондроитинсульфата [17] и гиалуроната натрия [18] также продемонстрировали определенную эффективность при отсутствии значимых побочных эффектов.
Цель исследования – оценить эффективность гликозаминогликанзаместительной терапии хронического лучевого цистита методом инстилляций в мочевой пузырь 0,08 % раствора гиалуроната натрия в качестве монотерапии и в комбинации с пероральным приемом хондроитинсульфата и гиалуроната натрия.
Материалы и методы
Исследование проводили ретроспективно на базе 2 клиник: Международного медицинского центра «УРО-ПРО» (г. Краснодар) и Медицинского центра «УРО-ПРО» (г. Краснодар).
В исследовании приняли участие 23 пациентки, которые были рандомизированы на 2 группы: пациентки 1‑й (n = 12) получали терапию методом инстилляций гиалуроната натрия; 2‑й (n = 11) – методом инстилляций гиалуроната натрия в сочетании с пероральным приемом хондроитинсульфата и гиалуроната натрия. Рандомизацию проводили методом генерации случайных чисел. Средний возраст пациенток составил 47,8 года (33–62 года).
Всем пациенткам осуществляли дистанционную лучевую терапию по поводу рака шейки матки (n = 16) и рака тела матки (n = 7). Среднее время от момента окончания лучевой терапии составило 24,6 мес (12–41 мес).
Пациенткам 1‑й группы проводили инстилляции 50 мл 0,08 % раствора гиалуроната натрия в мочевой пузырь 2 раза в неделю в течение 12 нед, 24 инстилляции на курс. Экспозиция от 30 мин до 2 ч, в зависимости от возможности пациентки удерживать мочу и емкости мочевого пузыря.
Пациенткам 2‑й группы выполняли инстилляции 50 мл 0,08 % раствора гиалуроната натрия в мочевой пузырь 2 раза в неделю в течение 12 нед, 24 инстилляции на курс, в комбинации с пероральным приемом 200 мг хондроитинсульфата и 100 мг гиалуроната натрия 3 раза в день в течение 12 нед.
Оценивали следующие параметры:
• емкость мочевого пузыря (дневник мочеиспускания);
• выраженность поллакиурии (дневник мочеиспускания);
• интенсивность болевого синдрома по визуальной аналоговой шкале (0–10);
• выраженность гематурии по шкале Droller (0–4).
Данные параметры сравнивали до начала терапии и через 2 нед после ее окончания. Для оценки достоверности различий оцениваемых параметров до терапии и после нее использовали парный t-критерий Стьюдента.
Результаты
Результаты терапии приведены в таблице. Из побочных эффектов отмечено усиление болевого синдрома после инстилляции у 3 пациенток (I степень тяжести по классификации Clavien–Dindo),
вследствие чего 1 больная прекратила терапию.
У 2 оставшихся пациенток при повторных инстилляциях болевой синдром не проявлялся. Побочные эффекты пациентов представлены на рис. 3–5.
| Показатель |
1-я группа 1st group |
2-я группа 2nd group |
|
Поллакиурия до лечения в сутки Pollakiuria before treatment per day |
28,2 (24–36) |
28,2 (24–36) |
|
Поллакиурия после лечения в сутки Pollakiuria after treatment per day |
14,3 (р = 0*) | 11,5 (р = 0*) |
|
Емкость мочевого пузыря до лечения, мл Bladder volume before treatment, ml |
88,1 (58–112) | |
|
Емкость мочевого пузыря после лечения, мл Bladder volume after treatment, ml |
127,5 (82–164) (р = 0,000 016*) | 144,4 (118–168) (р = 0,000 001*) |
|
Интенсивность боли до лечения, число баллов по визуальной аналоговой шкале Pain intensity before treatment, score per the visual analogue scale |
6,3 | 6,3 |
|
Интенсивность боли после лечения, число баллов по визуальной аналоговой шкале Pain intensity after treatment, score per the visual analogue scale |
2,8 (р = 0*) | 1,6 (р = 0,000 002*) |
|
Гематурия до лечения, число баллов по шкале Droller Hematuria before treatment, score per the Droller scale |
3,1 | 3,1 |
|
Гематурия после лечения, число баллов по шкале Droller Hematuria after treatment, score per the Droller scale |
1,41 (р = 0*) | 1,1 (р = 0,000 027*) |
Обсуждение
Гликозаминогликанзаместительная терапия является перспективным методом лечения и, возможно, профилактики хронического лучевого цистита.
J. M. Delgado Perez с соавт. провели исследование эффективности инстилляций гиалуроната натрия во время курса лучевой терапии рака шейки или тела матки в целях профилактики осложнений. Результаты исследования продемонстрировали эффективность такой профилактики [19].
М. Sommarivaс и соавт. выполняли гликозаминогликанзаместительную терапию лучевого цистита методом инстилляций в мочевой пузырь гиалуроната натрия в комбинации с хондроитинсульфатом на протяжении 12 мес. В начале терапии средняя емкость мочевого пузыря составляла 66,9 мл, после 3 мес терапии – 101,9 мл и через 12 мес – 174,4 мл [20].
Таким образом, инстилляции 2 основных компонентов ГАГ-слоя продемонстрировали достоверную эффективность. Комбинация ГАГ представляется более эффективным методом по сравнению с монотерапией [20].
Следует отметить, что результаты сочетания внутрипузырных инстилляций ГАГ с их пероральным приемом были представлены на конгрессе Европейского общества по изучению интерстициального цистита (ESSIC) применительно к терапии интерстициального цистита [21].
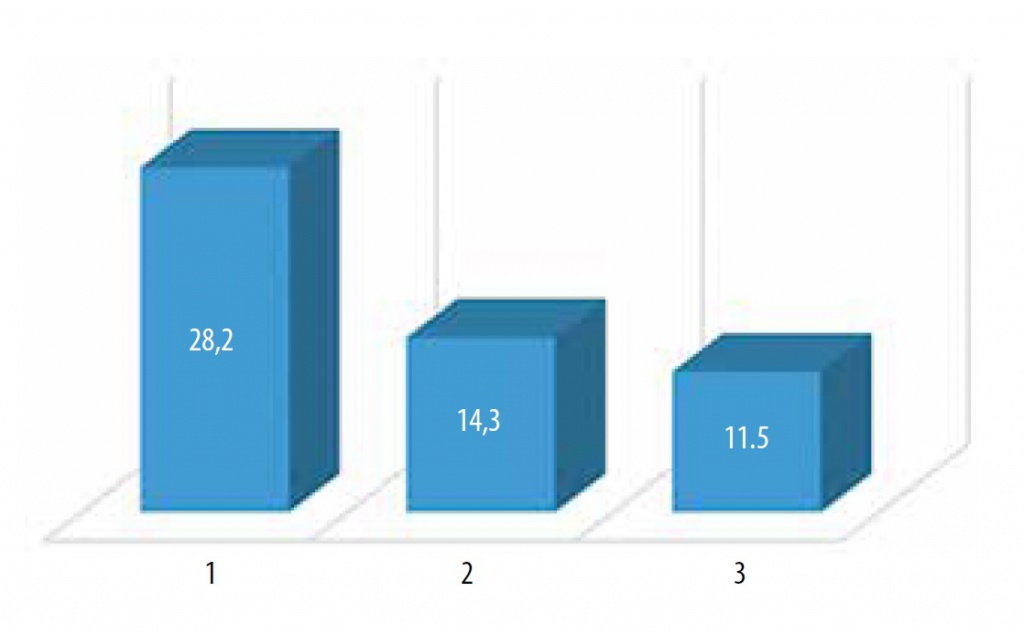
Рис. 3. Поллакиурия до терапии (1), после курса инстилляций гиалуроната натрия (2), после курса комбинированной гликозамоногликанзаместительной терапии (инстилляции и пероральный прием)
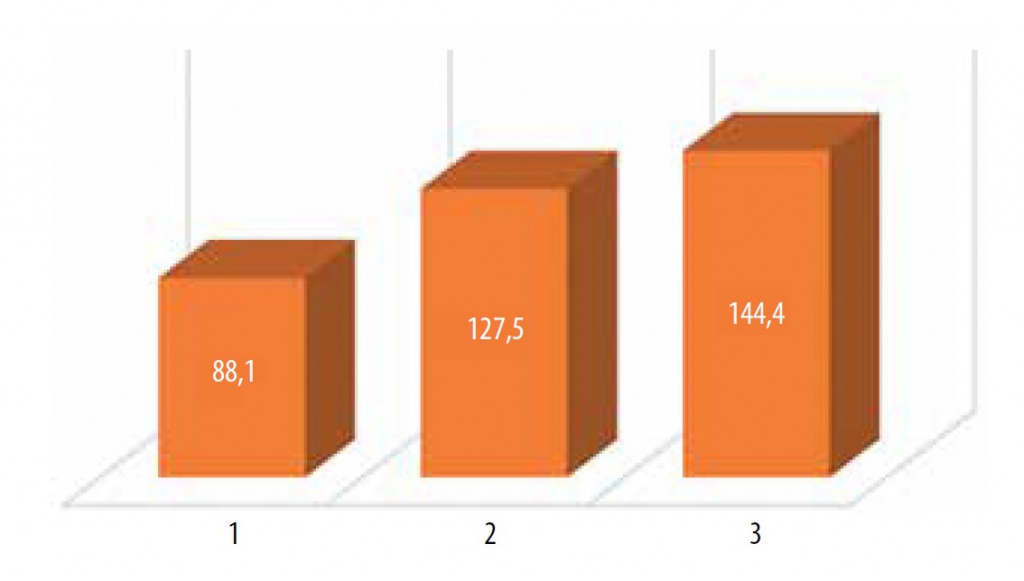
Рис. 4. Объем мочевого пузыря (мл) до терапии (1), после курса инстилляций гиалуроната натрия (2), после курса комбинированной гликозаминогликанзаместительной терапии (инстилляции и пероральный прием).
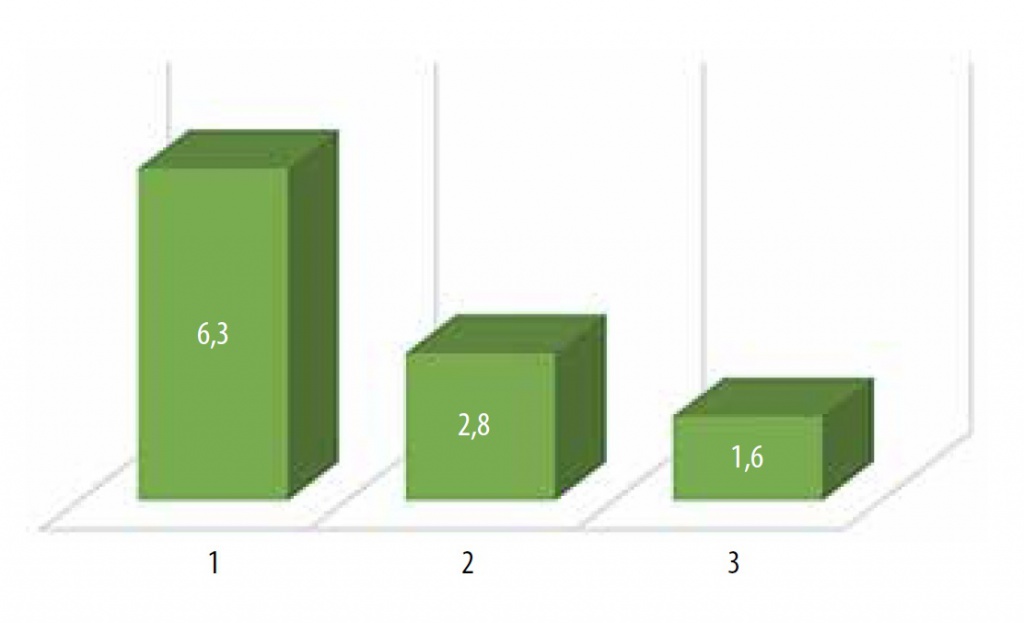
Рис. 5. Интенсивность боли (баллы) по визуальной аналоговой шкале до терапии (1), после курса инстилляций гиалуроната натрия (2), после курса комбинированной гликозаминогликанзаместительной терапии (инстилляции и пероральный прием).
Заключение
Результаты исследования, представленные в настоящей статье, демонстрируют достоверную эффективность гликозаминогликанзаместительной терапии хронического лучевого цистита.
Комбинация внутрипузырных инстилляций ГАГ в сочетании с их пероральным приемом представляется более эффективной, по сравнению с монотерапией. Для более достоверной оценки необходимо проведение мультицентровых клинических исследований с бόльшим числом пациентов.
Литература
1. Lopez-Beltran A., Luque R.J., Mazzucchelli R. et al. Сhanges produced in the urothelium by traditional and newer therapeutic procedures for bladder cancer. J ClinPathol 2002;55(9):641–7. PMID: 12194991.
2. Parsons C.L. Interstitial cystitis: epidemiology and clinical presentation. Clin Obstet Gynecol 2002;45(1):242–9. PMID: 11862076.
3. Ruggieri M.R., Chelsky M.J., Rosen S.I. et al. Current findings and future research avenues in the study of interstitial cystitis. Urol Clin North Am 1994;21(1):163–76. PMID: 8284840.
4. Corman J.M., McClure D., Pritchett R. et al. Treatment of radiation induced hemorrhagic cystitis with hyperbaric oxygen. J Urol 2003;169(6):2200–2. DOI: 10.1097/01. ju.0000063640.41307.c9. PMID: 12771749.
5. Droller M.J., Saral R., Santos G. Prevention of cyclophosphamide-induced hemorrhagic cystitis. Urology 1982;20(3):256–8. PMID: 7123717.
6. Cox J.D., Stetz J., Pajak T.F. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995;31(5):1341–6. DOI: 10.1016/0360-3016(95)00060-C. PMID: 7713792.
7. Trotman J., Nivison-Smith I., Dodds A. Haemorrhagic cystitis: incidence and risk factors in a transplant population using hyperhydration. Bone Marrow Transplant 1999;23(8):797–801. DOI: 10.1038/sj. bmt.1701644. PMID: 10231142.
8. Murphy C., Harden E., Stevens D. et al. The addition of mesna to hyperhydration does not decrease the incidence of hemorrhagic cystitis in patients receiving high-dose cyclophosphamide. Oncol Rep 1994;1(1):265–6. PMID: 21607351.
9. Nakada T., Nakada H., Yoshida Y. et al. Hyperbaric oxygen therapy for radiation cystitis in patients with prostate cancer: a long-term follow-up study. Urol Int 2012;89(2): 208–14. DOI: 10.1159/000338910. PMID: 22797611.
10. Singh I., Laungani G.B. Intravesical epsilon aminocaproic acid in management of intractable bladder hemorrhage. Urology 1992;40(3):227–9. PMID: 1523745.
11. Arrizabalaga M., Extramiana J., Parra J.L. et al. Treatment of massive haematuria with aluminous salts. Br J Urol 1987;60(3): 223–6. PMID: 3676666.
12. Perazella M., Brown E. Acute aluminum toxicity and alum bladder irrigation in patients with renal failure. Am J Kidney Dis 1993;21(1):44–6. PMID: 8418625.
13. Raghavaiah N.V., Soloway M.S. Anuria following silver nitrate irrigation for intractable bladder hemorrhage. J Urol 1977;118(4):681–2. PMID: 916077.
14. Vicente J., Rios G., Caffaratti J. Intravesical formalin for the treatment of massive hemorrhagic cystitis: retrospective review of 25 cases. Eur Urol 1990;18(3):204–6. PMID: 2261933.
15. McIvor J., Williams G., Southcott R.D. Control of severe vesical haemorrhage by therapeutic embolisation. Clin Radiol 1982;33(5):561–7. PMID: 7116778.
16. Hampson S.J., Woodhouse C.R. Sodium pentosanpolysulphate in the management of haemorrhagic cystitis: experience with 14 patients. Eur Urol 1994;25(1):40–2. PMID: 7508397.
17. Hazewinkel M.H., Stalpers L.J., Dijkgraaf M.G., Roovers J.P. Prophylactic vesical instillations with 0.2 % chondroitin sulfate may reduce symptoms of acute radiation cystitis in patients undergoing radiotherapy for gynecological malignancies. Int Urogynecol J 2011;22(6):725–70. DOI: 10.1007/ s00192-010-1357-0. PMID: 21365332.
18. Shao Y., Lu G.L., Shen Z.J. Comparison of intravesical hyaluronic acid instillation and hyperbaric oxygen in the treatment of radiation- induced hemorrhagic cystitis. BJU Int 2012;109(5):691–4. DOI: 10.1111/j.1464-410X. 2011.10550.x. PMID: 21895939.
19. Delgado Perez J.M., Samper P., Garrido J.S. Hyaluronic acid in the prevention of radiation- induced cystitis. Proc Am Soc Clin Oncol 2003;22.
20. Sommariva M., Lazzeri M., Abrate A. et al. Intravescial hyaluronic acid and chondroitin sulphate improve symptoms and quality of life in patients with late radiation tissue cystitis: an investigative pilot study. Eur J Inflammation 2014;12:177–85.
21. Mirkin Y.B. Comparison of efficacy intravesical, oral and combined GAG-replenishment therapy as Painful Bladder Syndrome treatmentmodality. ESSIC Annual Meeting, 2017.
 Версия для слабовидящих
Версия для слабовидящих


