15.08.2025
УРОЛАЙФ ПЕНТА И УРОЛАЙФ PRO
Новые возможности для комплексной (внутрипузырной и пероральной)
гликозаминогликан-заместительной терапии интерстициального и лучевого цистита
Яков Миркин
Доказано, что повреждение гликозаминогликанового слоя (ГАГ) слизистой оболочки мочевого пузыря, играет важную роль в патогенезе и клиническом прогрессировании хронических воспалительных заболеваний мочевого пузыря, таких как:
- постлучевой цистит,
- синдром болезненного мочевого пузыря/интерстициальный цистит
- рецидивирующие инфекции нижних мочевыводящих путей.
Целью данного обзора является изучение современных данных о роли восстановления ГАГ с помощью внутрипузырного применения гиалуроновой кислоты и хондроитинсульфата, а также перорального назначения компонентов ГАГ-слоя в лечении пациентов с интерстициальным и постлучевым циститом. Рассмотренные исследования последовательно демонстрируют, что восстановление ГАГ может приводить к различной степени клинического улучшения у пациентов с постлучевым циститом, синдромом болезненного мочевого пузыря и рецидивирующими инфекциями мочевыводящих путей. Также мы приведем данные собственных исследований эффективности комбинированной ГАГ-заместительной терапии, в том числе внутрипузырного введения компонентов ГАГ-слоя в комбинации с мукоадгезивным полимером.
Эпителий мочевого пузыря, также известный как «переходный эпителий» или «уротелий», — это не только барьер от агрессивных компонентов мочи, но и специализированная ткань, регулирующая функции мочевого пузыря и играющая активную роль в патогенезе многих его заболеваний.
Имеющиеся данные свидетельствуют о том, что уротелий выполняет две основные активные функции:
- «афферентную», которая информирует центральную нервную систему о локальных стимулах и таким образом, участвует в регуляции рефлекса мочеиспускания, модуляции болевых и сердечно-сосудистых рефлексов;
- «эфферентную» (или паракринную) функцию, связанную с высвобождением медиаторов, таких как субстанция P и тахикинины, вызывающих сокращение гладких мышц и местное воспаление.
Также мы знаем, что уротелий покрыт толстым слоем гликозаминогликанов, которые выполняют антиадгезивную роль, предохраняя таким образом уротелий от адгезии потенциальных возбудителей цистита или проникновения агрессивных компонентов мочи (таких как ионы калия или мочевина).
Гликозаминогликаны представляют собой мукополисахариды, отличающиеся значительным отрицательным зарядом.
Существует два основных типа ГАГ:
- несульфатированные ГАГ, то есть гиалуроновая кислота (ГК),
- сульфатированные ГАГ, то есть: гепарансульфат и гепарин, хондроитинсульфат (ХС), дерматансульфат и кератансульфат.
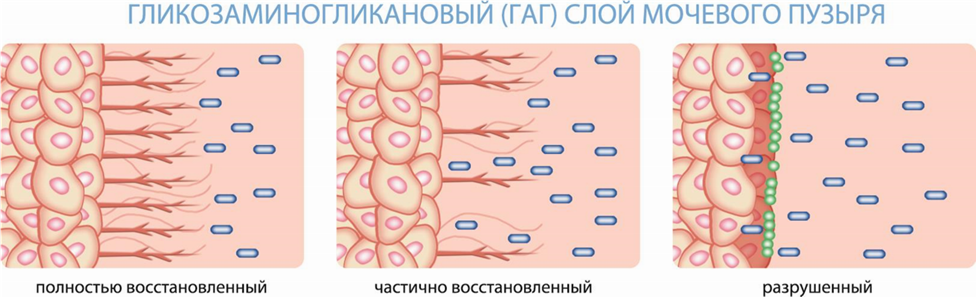
Имеются убедительные доказательства того, что различные хронические воспалительные заболевания мочевого пузыря, такие как рецидивирующая инфекция мочевыводящих путей, лучевой цистит, а также синдром болезненного мочевого пузыря (СБМП)/интерстициальный цистит (ИЦ), могут быть патофизиологически связаны на первом этапе заболевания с разрушением защитного слоя слизистой. Цепь событий, начинающаяся с незаживающего повреждения ГАГ-слоя, может привести к хроническому повреждению эпителия мочевого пузыря и нейрогенному воспалению [2].
Таким образом, повреждение и потеря ГАГ-слоя считаются пусковыми механизмами хронических воспалительных заболеваний мочевого пузыря, включая СБМП/ИЦ, постлучевой цистит и инфекции мочевыводящих путей (МВП). Токсическое воздействие мочи на уротелиальные клетки приводит к их нейрогенному повреждению и воспалению [3]. Активация нервных волокон в подслизистом слое приводит к нейрональной гиперчувствительности (периферической и центральной сенситизации).
Следовательно, введение в мочевой пузырь компонентов ГАГ-слоя должно положительно воздействовать на течение перечисленных ниже заболеваний:
- Интерстициальный цистит/Синдром болезненного мочевого пузыря
- Лучевой цистит
- Химиотерапевтический цистит
- Рецидивирующие инфекции нижних МВП
Существует значительное количество исследований, подтверждающих этот постулат.
Например, Damiano и соавторы вводили в мочевой пузырь комбинацию гиалуроновой кислоты и хондроитинсульфата с целью предотвращения рецидивов бактериального цистита. В исследовании участвовали 57 женщин, которые были разделены на две группы: первая группа получала инстилляции ГК + ХС один раз в неделю в первый месяц, далее один раз в месяц в течение 5 месяцев. Вторая группа получала инстилляции плацебо в таком же режиме.
Исследование продемонстрировало, что среднее время до рецидива ИМП (52,7 ± 33,4 против 185,2 ± 78,7 дней; p<0,001) были значительно ниже после лечения ГК + ХС по сравнению с плацебо [4].
Cicione и соавторы выполнили мультицентровое исследование эффективности инстилляций ГК + ХС в качестве метода предотвращения рецидивов инфекций нижних МВП.
Всего в исследование было включено 157 женщин (средний возраст: 54,2 ± 4,1 года). Все пациентки находились под наблюдением не менее 12 месяцев. После 4 еженедельных и 5 ежемесячных инстилляций HA-CS в мочевой пузырь количество эпизодов ИМП в год снизилось с 4,13 ± 1,14 до 0,44 ± 0,50 (p = 0,01), в то время как продолжительность периода между рецидивами инфекций МВП увеличилась с 94,8 ± 25,1 дня до 178,4 ± 37,3 дня (p = 0,01) через 12 месяцев [5].
Интерстициальный цистит/Синдром Болезненного Мочевого пузыря
В настоящее время рекомендуется употребление термина Первичный Мочепузырный Болевой Синдром. Независимо от терминологии, заболевание проявляется следующими симптомами:
- Боль в низу живота или промежности, связанная с наполнением мочевого пузыря
- Поллакиурия
- Ноктурия
Диагноз ставится на основании клинической картины, подтвержденной опросниками, а также характерных цистоскопических изменений (гломеруляции и/или Гуннеровские поражения) при цистоскопии под общей анестезией.
Исследования продемонстрировали эффективность ГАГ-заместительной терапии ИЦ/СБМП при помощи инстилляций мочевого пузыря растворами гиалуроновой кислоты, хондроитинсульфата а также их комбинации. В частности Giberti исследовал эффективность инстилляций ГК + ХС у 20 пациенток с ИЦ/СБМП. Эффективность оценивалась по клиническим проявлениям заболевания на основании заполненных опросников O’Leary – Saints и PUF. Наблюдалось статистически значимое снижение средних баллов по опросникам O’Leary-Saints (с 13,0 до 9,3; p = 0,0003), (с 11,35 до 8,85; p = 0,0078) и PUF (с 20,0 до 15,75; p = 0,0007) [6].
Kwang Taek Kim выполнил исследование эффективности оральной терапии ИЦ/СБМП при помощи ГК + ХС. Дизайн исследования предусматривал 12 недель терапии пентосанполисульфатом (ППС) и затем 8 недель комбинированной терапии ППС + ГК + ХС. Комбинированная терапия продемонстрировала более высокую клиническую эффективность по сравнению с монотерапией ППС [7]. Также, пероральная ГАГ-заместительная терапия ГК + ХС продемонстрировала эффективность в лечении цистита после химиотерапии рака мочевого пузыря митомицином[8].
Таким образом, лечение цистита после лучевой и химиотерапии, рецидивирующего бактериального цистита при помощи комбинированного применения (внутрипузырного и перорального) гиалуроновой кислоты и хондроитинсульфата представляется перспективным решением.
Компания «Ривьера Биотек» разработала комбинированные препараты для внутрипузырной – «Уролайф PRO» и пероральной – «Уролайф ПЕНТА» терапии хронического цистита.
- Гиалуронат натрия высокой и низкой молекулярной массы (3 000 kDa + 5 000 Da )
- Хондроитинсульфат (20 000 Da)
- Поликватерниум 10
Локальное введение препаратов в мочевой пузырь эффективно, поскольку позволяет создать высокую концентрацию препарата в уротелии и на его поверхности. Недостатком внутрипузырной терапии является кратковременная экспозиция препарата в мочевом пузыре.
Таким образом, необходимо разработать методы пролонгации действия препарата.
Известно, что уротелий заряжен отрицательно, соответственно решением может являться введение в композицию положительно заряженных компонентов.
Для этого в состав «УРОЛАЙФ PRO» введен поликватерниум 10 – синтетический катионный полимер, который обеспечивает адгезию гиалуроновой кислоты к уротелию.
Кроме того, к настоящему времени представление о ГАГ-заместительной терапии значительно изменилось. Цели такой терапии не ограничиваются созданием муциновой пленки на поверхности уротелия. Эпителий мочевого пузыря представляет собой сложную анатомическую структуру. Уротелий состоит из трех слоев: базальных, промежуточных и поверхностных клеток, также известных как зонтичные клетки или фасеточные клетки. Базальные клетки являются наиболее недифференцированным типом уротелиальных клеток, расположенных на базальной мембране просвета и выполняющих роль предшественников. Промежуточные клетки обладают высокой пролиферативной способностью, образуя несколько клеточных слоев в зависимости от вида. Во время травмы или инфекции промежуточные клетки отвечают за быструю регенерацию уротелия. На апикальной поверхности полностью дифференцированные зонтичные клетки отвечают за поддержание низкой проницаемости и барьерной функции уротелия [9]. Базальный слой клеток расположен вдоль базальной мембраны (рис. 1); они являются самыми маленькими из уротелиальных клеток (5–10 мкм в диаметре), но составляют самую многочисленную популяцию клеток во взрослом уротелии.
Они прикреплены непосредственно к базальной мембране через гемидесмосомы и к лежащим выше промежуточным клеткам через десмосомы [10].
Было высказано предположение, что базальные клетки представляют собой уротелиальные стволовые клетки, обеспечивающие пожизненную регенерацию уротелия.
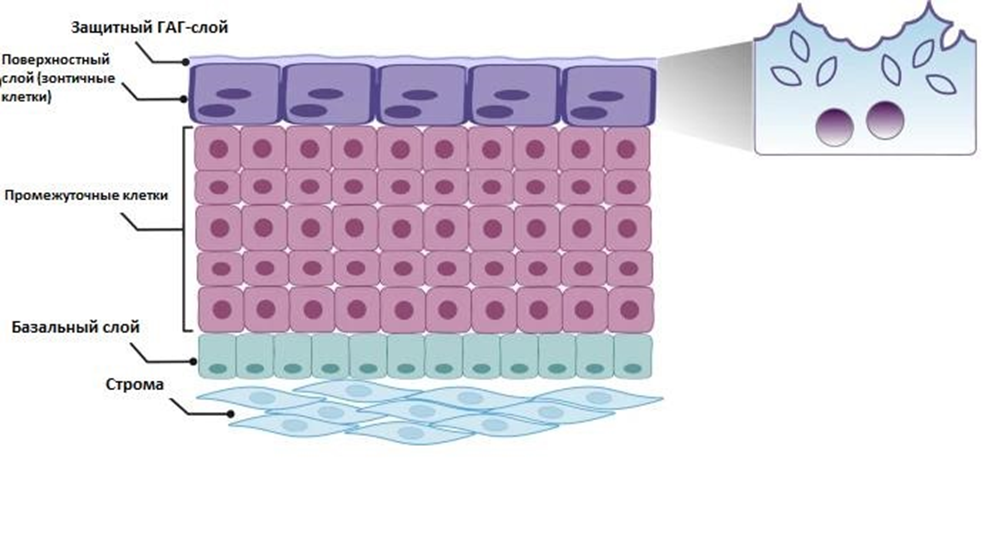
Все три слоя клеток уротелия соединены между собой белками плотных контактов. Комплекс межклеточных соединений состоит из кольцевидного плотного контакта , адгезивного контакта и десмосом. Плотные контакты являются наиболее апикальными межклеточными соединениями. Ключевыми молекулярными компонентами плотных контактов являются клаудины и окклюдины. Белки плотных контактов вместе с белками адгезивных контактов (кадгеринами и катенинами) образуют комплекс уротелиальных соединений. Зонтичные клетки покрыты слоем гликокаликса, который состоит из связанных с мембраной гликопротеинов и гликолипидов, а также растворимых компонентов, включая галектины и протеогликаны.
Гликозаминогликаны (ГАГ), состоящие из неразветвленных углеводов с повторяющимися дисахаридными единицами, прикреплены к основному белку, образуя протеогликан. Слой ГАГ состоит в основном из гепаринсульфата, дерматансульфата, хондроитинсульфата, гиалуроновой кислоты и кератансульфата [11]. Хондроитинсульфат и гиалуроновая кислота, два основных компонента, которые играют центральную роль в формировании барьера и антибактериальной защите. Имеются убедительные доказательства того, что гликокаликс может обладать неспецифическими защитными и антиадгезивными свойствами для защиты от патогенных микроорганизмов.
Клетки каждого слоя соединены между собой белками плотных контактов. Пространство между клетками служит для парацеллюлярного транспорта ионов и молекул. Транспорт может регулироваться в зависимости от потребностей уротелия.
Клетки также связаны между собой синдеканами – трансмебранными гепарансульфатпротеогликанами. Таким образом, для полноценного функционирования уротелия необходим защитный слой, который состоит из гликозаминогликанов:
- Гиалуроновая кислота
- Хондроитинсульфат
- Гепарансульфат
- Дерматансульфат
Также необходим межклеточный матрикс, в состав которого также входят гликозаминогликаны, в частности хондроитинсульфат. Следовательно, идеальная ГАГ – заместительная терапия должна включать эти компоненты. Для лучшего проникновения в межклеточный матрикс оптимальным является низкомолекулярный хондроитинсульфат (20 000 – 100 000 Da).
Для поддержания непрерывности гликозаминогликан-заместительной терапии оптимальным представляется комбинация локальной терапии (инстилляций мочевого пузыря гиалуроновой кислотой и хондроитинсульфатом) и пероральной ГАГ-заместительной терапии (прием гликозаминогликанов внутрь).
Опубликованы работы, демонстрирующие эффективность пероральной ГАГ-заместительной терапии, в частности Theoharides исследовал эффективность БАД “CystoProtec” (гиалуронат натрия и хондроитинсульфат) в терапии интерстициального цистита. Тридцать семь пациенток с диагнозом ИЦ, у которых все виды терапии оказались неэффективны, принимали по шесть капсул “CystoProtek” в день в течение 6 месяцев. Симптомы по Global Assestment Scale снизились с 9,0 ± 2,9 до 4,3 ± 2,1 (p < 0,05); кроме того, индекс симптомов O’Leary/Saints снизился с 15,3 ± 3,1 до 6,9 ± 4,2 (p < 0,05), а индекс проблем O’Leary/Saints – с 13,1 ± 3,7 до 5,4 ± 4,0 (p < 0,05) [12].
Также Kim и соавторы исследовали эффективность применения корейского БАД “CystoChon” (гиалуронат натрия, хондроитинсульфат, экстракт клюквы) при интерстициальном цистите.
Дизайн исследования предусматривал 12 недель терапии пентосанполисульфатом (ППС) и затем 8 недель комбинированной терапии ППС + ГК + ХС.
Комбинированная терапия продемонстрировала более высокую клиническую эффективность по сравнению с монотерапией ППС [13]. Manfredi и соавторы провели исследование эффективности капсул Ialuril (хондроитинсульфат, гиалуроновая кислота, кверцетин) для профилактики осложнений химиотерапии рака мочевого пузыря.
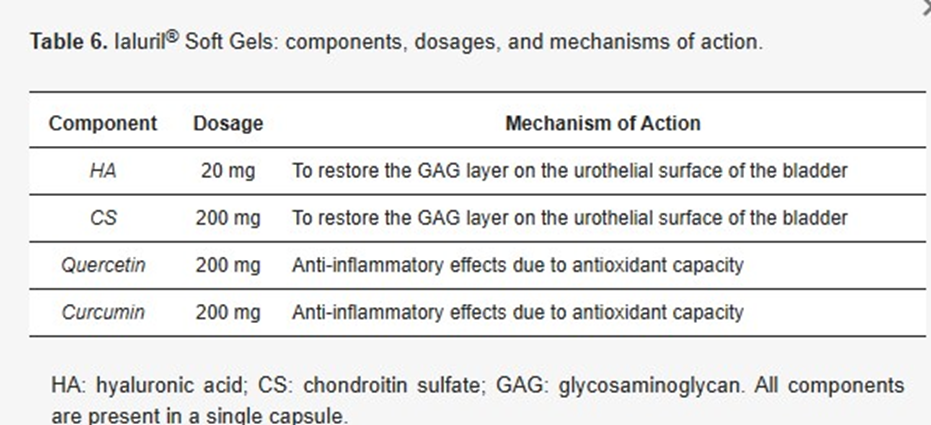
Исследование было плацебо-контролируемым. В группе Ialuril было отмечено значительное улучшение симптомов (IPSS, VAS) по сравнению с группой плацебо.
Таким образом, пероральная ГАГ-заместительная терапия является эффективным методом восстановления эпителия мочевого пузыря. Компания «Ривьера Биотек» разработала БАД «Уролайф ПЕНТА» для пероральной ГАГ-заместительной терапии.
Состав:
|
- Гиалуроновая кислота |
- 50 мг |
|
- Хондроитинсульфат |
- 150 мг |
|
- Глюкозамина гидрохлорид |
- 100 мг |
|
- Дерматансульфат |
- 50 мг |
|
- Магния цитрат |
- 100 мг |
|
Дозировка: |
по 1 капсуле 3 раза в день |
|
Курс лечения: |
3 – 9 месяцев |
На базе клиники «УРО-ПРО» (г. Краснодар) выполнено пилотное исследование эффективности пероральной ГАГ-заместительной терапии интерстициального цистита/первичного мочепузырного болевого синдрома при помощи «Уролайф ПЕНТА». В исследовании участвовали 23 женщины, которые получали монотерапию: по 1 капсуле «Уролайф ПЕНТА» 3 раза в день в течение 3-х месяцев. Боль по Визуальной Аналоговой Шкале снизилась с 5.25 до 2.12 баллов.
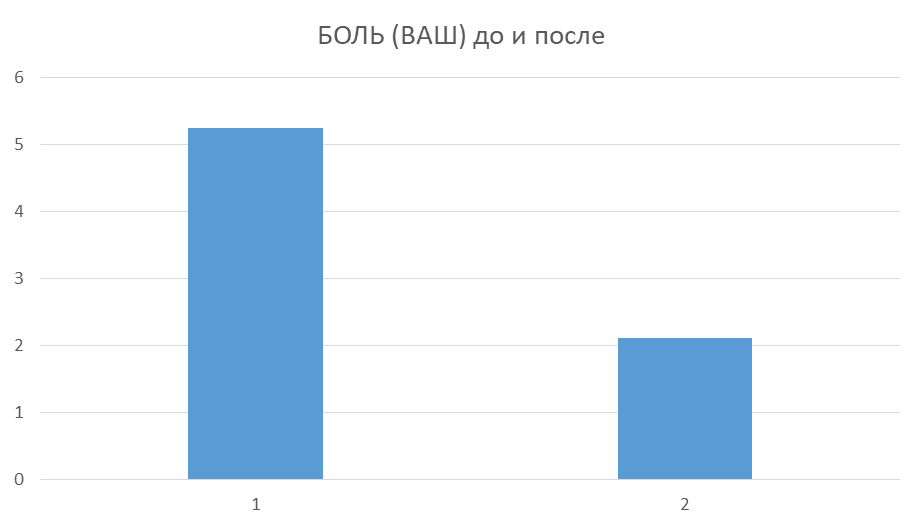
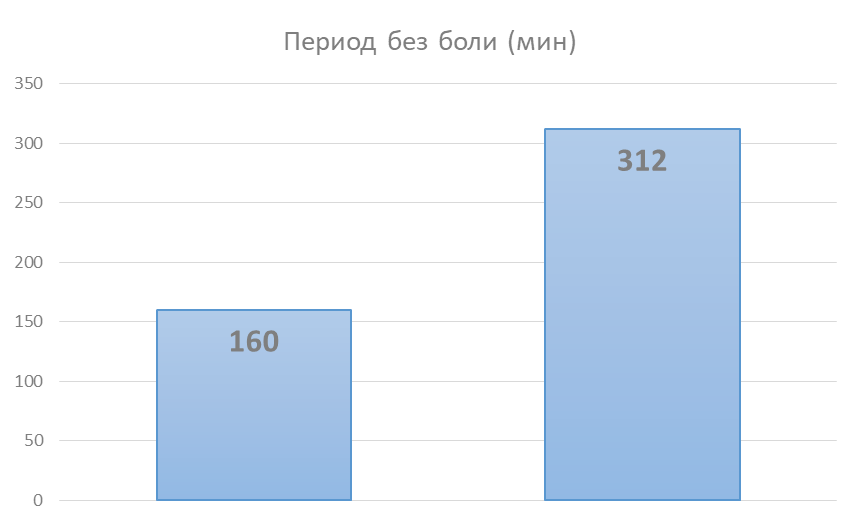
Также было проведено сравнительное исследование продолжительности действия медицинского изделия протектор эпителия мочевого пузыря «Уролайф» с гиалуроновой кислотой, хондроитинсульфатом и поликватерниумом («Уролайф ПРО») и «Уролайф» с гиалуроновой кислотой («Уролайф»). Для этого перед инстилляцией мочевого пузыря в протектор добавляли 10 мл 10% лидокаина на 50 мл «Уролайф». Затем раствор «Уролайфа» с лидокаином вводили в мочевой пузырь и измеряли продолжительность периода, когда пациент не испытывает боли.
У пациентов, получавших «Уролайф ПРО» + лидокаин, период без боли составил в среднем 312 минут, при этом у пациентов получавших «Уролайф» + лидокаин безболевой период составил в среднем 160 минут.
Таким образом, доказана возможность пролонгации действия композиции для внутрипузырных инстилляций при помощи добавления катиона.
Оптимальным представляется комбинированная терапия различных видов хронического цистита:
- Внутрипузырные инстилляции «Уролайф ПРО»: 1-2 инстилляции в неделю, продолжительность терапии 3–6 месяцев.
- Пероральный прием «Уролайф ПЕНТА»: 1 капсула 3 раза в день, продолжительность лечения 3–6 месяцев.
Список литературы:
1.Madersbacher H, van Ophoven A, van Kerrebroeck PE. GAG layer replenishment therapy for chronic forms of cystitis with intravesical glycosaminoglycans—a review. Neurourol Urodyn. 2013;32(1):9–18. doi: 10.1002/nau.22256.
2.Damiano R, Cicione A. The role of sodium hyaluronate and sodium chondroitin sulphate in the management of bladder disease. Ther Adv Urol. 2011;3(5):223–232. doi: 10.1177/1756287211418723.
3.Geppetti P, Nassini R, Materazzi S, Benemei S. The concept of neurogenic inflammation. BJU Int. 2008;101(Suppl 3):2–6. doi: 10.1111/j.1464-410X.2008.07493.x.
4.Damiano R, Quarto G, Bava I, Ucciero G, De Domenico R, Palumbo MI, Autorino R. Prevention of recurrent urinary tract infections by intravesical administration of hyaluronic acid and chondroitin sulphate: a placebo-controlled randomised trial. Eur Urol. 2011 Apr;59(4):645-51. doi: 10.1016/j.eururo.2010.12.039. Epub 2011 Jan 18. Erratum in: Eur Urol. 2011 Jul;60(1):193. PMID: 21272992.
5.Cicione A, Cantiello F, Ucciero G, Salonia A, Torella M, De Sio M, Autorino R, Carbone A, Romancik M, Tomaskin R, Damiano R. Intravesical treatment with highly-concentrated hyaluronic acid and chondroitin sulphate in patients with recurrent urinary tract infections: Results from a multicentre survey. Can Urol Assoc J. 2014 Sep;8(9-10):E721-7. doi: 10.5489/cuaj.1989. PMID: 25408813; PMCID: PMC4216305.
6.Giberti C, Gallo F, Cortese P, Schenone M. Combined intravesical sodium hyaluronate/chondroitin sulfate therapy for interstitial cystitis/bladder pain syndrome: a prospective study. Ther Adv Urol. 2013 Aug;5(4):175-9. doi: 10.1177/1756287213490052. PMID: 23904856; PMCID: PMC3721440.
7. Kim KT, Lee JW, Choe HS. Pilot Study of Cystochon<sup>®</sup> (Cranberry Extract, Chondroitin Sulfate, and Hyaluronic Acid Complex) in Interstitial Cystitis/Bladder Pain Syndrome. Urogenit Tract Infect. 2022;17(2):36-41.
8. Manfredi C, Spirito L, Calace FP, Balsamo R, Terribile M, Stizzo M, Romano L, Napolitano L, Califano G, Cirillo L, Fusco GM, Rosati C, Quattrone C, Sciorio C, Creta M, Longo N, De Sio M, Arcaniolo D. Oral Preparation of Hyaluronic Acid, Chondroitin Sulfate, Curcumin, and Quercetin (Ialuril® Soft Gels) for the Prevention of LUTS after Intravesical Chemotherapy. Pathophysiology. 2022 Jul 13;29(3):365-373. doi: 10.3390/pathophysiology29030028. PMID: 35893598; PMCID: PMC9326532.
9. Jaimes-Parra, B. D. et al. Ex vivo construction of a novel model of bioengineered bladder mucosa: a preliminary study. Int. J. Urol. 23, 85–92 (2016).
10. Jones, J. C. R. Hemidesmosomes in Bladder Epithelial. Cells 57, 2001 (2001).
11. Klingler, C. H. Glycosaminoglycans: how much do we know about their role in the bladder? Urologia 83, 11–14 (2016).
12. Theoharides, Theoharis & Sant, Grannum. (2005). A Pilot Open Label Study of Cystoprotek® in Interstitial Cystitis. International journal of immunopathology and pharmacology. 18. 183-8. 10.1177/039463200501800119.
13. Kim KT, Lee JW, Choe HS. Pilot Study of Cystochon ® (Cranberry Extract, Chondroitin Sulfate, and Hyaluronic Acid Complex) in Interstitial Cystitis/Bladder Pain Syndrome. Urogenit Tract Infect. 2022;17(2):36-41.
14. Manfredi C, Spirito L, Calace FP, Balsamo R, Terribile M, Stizzo M, Romano L, Napolitano L, Califano G, Cirillo L, Fusco GM, Rosati C, Quattrone C, Sciorio C, Creta M, Longo N, De Sio M, Arcaniolo D. Oral Preparation of Hyaluronic Acid, Chondroitin Sulfate, Curcumin, and Quercetin (Ialuril® Soft Gels) for the Prevention of LUTS after Intravesical Chemotherapy. Pathophysiology. 2022 Jul 13;29(3):365-373. doi: 10.3390/pathophysiology29030028. PMID: 35893598; PMCID: PMC9326532.
 Версия для слабовидящих
Версия для слабовидящих